Project 11
Spatial and temporal coordination of RNA translation, replication and assembly
in a membranous puls-strand RNA virus replication factory
Rohr, Karl
Biomedical Computer Vision Group, BioQuant, IPMB, Bioinformatics & Functional Genomics
Heidelberg University
News
20.11.2024 | R. Bartenschlager and F. Mücksch named as “Highly Cited Researchers 2024”
Two project leaders from SFB1129 are named among the most “Highly Cited Researchers 2024” [...]
16.11.2022 | Ralf Bartenschlager named as “Highly Cited Researcher” 2022
Among the most "Highly Cited Researchers" in his field (microbiology) worldwide is Prof. Dr. [...]
Information
Viral infections are a major cause of disease, with enormous costs resulting from morbidity/mortality and economic losses worldwide. Plus-strand RNA viruses encompass a large group that includes several medically highly relevant pathogens including hepatitis C virus (HCV), Dengue virus (DENV), West Nile virus (WNV), Tick-borne encephalitis virus (TBEV), entero- and coronaviruses. Productive replication of these viruses requires the formation of a cytoplasmic membranous replication factory that is induced by remodeling of intracellular membranes of the infected host cell. Based on the morphology of the membranous factories two different types are observed: (a) a factory composed primarily of double membrane vesicles or (b) formed by invagination of membranes into intracellular compartments. These morphotypes do not follow the phylogeny of the different virus groups but likely reflect the analogous use of cellular pathways and machineries. By using two plus-strand RNA viruses inducing either morphotype of the membranous replication factory, we aim to decipher the general principles of plus-strand RNA virus replication. This information might guide the development of novel broad-spectrum antiviral concepts targeting the biogenesis and functionality of membranous replication factories induced by this medically highly relevant virus group.
Viren sind eine bedeutsame Ursache für Infektionskrankheiten, die sehr hohe Kosten für das Gesundheitssystem sowie erhebliche wirtschaftliche Einbußen verursachen können. Plus-Strang RNA Viren sind eine große Gruppe von Erregern, zu denen beispielswiese das Hepatitis C Virus (HCV), das Dengue Virus (DENV), der Erreger der Frühsommer-Meningoenzephalitis (FSME) sowie Entero- und Coronaviren gehören, die von hoher medizinischer Relevanz sind und die größere Epidemien oder gar Pandemien verursachen können. Voraussetzung für die produktive Vermehrung (Replikation) dieser Viren ist die Ausbildung viraler Replikationsfabriken, deren wesentlicher Bestandteil intrazelluläre Membranen der infizierten Wirtszelle sind. Auf Grund der Morphologie der rearrangierten Membranen lassen sich zwei Typen unterscheiden: (a) Replikationsfabriken, die vorwiegend aus „Doppelmembranvesikeln bestehen und (b) Fabriken, die sich durch Einstülpungen in intrazelluläre Kompartimente bilden. Diese Morphotypen folgen überraschenderweise nicht der Taxonomie der Viren, spiegeln aber sehr wahrscheinlich die Aktivierung analoger zellulärer Prozesse wieder, die sich die jeweiligen Viren zu Nutze machen. Durch vergleichende Analyse zweier Viren, die jeweils einen der beiden Morphotypen der membranösen Replikationsfabriken induzieren wollen wir allgemeingültige Prinzipien der Replikationszyklen von Plusstrang RNA Viren identifizieren. Mit Hilfe dieser Information sollen zelluläre Faktoren und Prozesse identifiziert werden, die von bestimmten Virusgruppen gemeinsam genutzt werden, um somit Angriffsziele für die Entwicklung von Breitband-Virostatika zu definieren, die an der Biogenese und Funktionalität der Replikationsfabriken von Plusstrang RNA Viren angreifen.
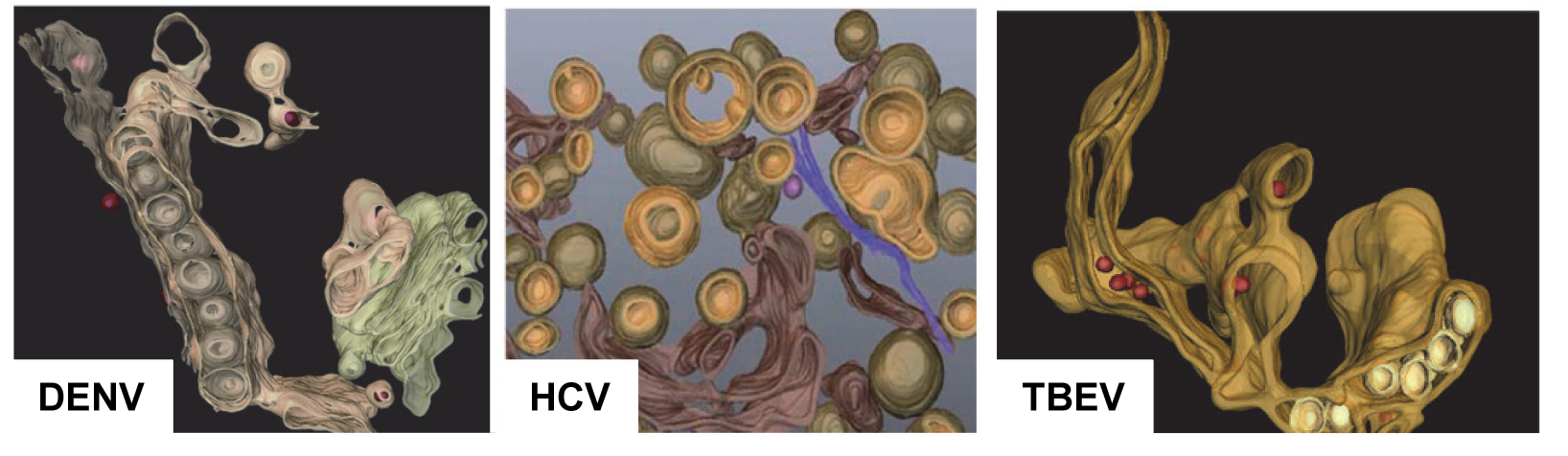
3D reconstruction of HCV-, DENV- and TBEV-induced membrane alterations (adapted from Romero-Brey et al., 2012; Welsch et al., 2009; Miorin et al., 2012)
________________________________________________

Tracking result of HCV particles. Section of an original microscopy image overlaid with computed trajectories (Godinez & Rohr, IEEE TMI 2015)
Project Staff

Olga Oleksiuk,
PostDoc

Ina Karen Stoeck,
PhD

Christian Ritter,
PhD



